Antes de passar aos exemplos de utilização do triângulo do fogo, algumas palavras sobre a energia de activação.
Se apenas houvesse necessidade do combustível e do comburente para se dar a combustão, tudo o que pode arder já teria ardido. Desde as florestas ao recheio das nossas casas, vemos materiais combustíveis rodeados de ar (que contém oxigénio).
Numa perspectiva microscópica, que é o nível onde as coisas acontecem, as reacções químicas ocorrem na sequência de choques entre moléculas. Se tivermos uma mistura de combustível e ar dentro de um reservatório, podemos visualizar as moléculas como partículas em movimento incessante, chocando entre si e com as paredes do reservatório. As moléculas possuem energia sob diversas formas: translacção, rotação, vibração e electrónica. Podemos considerar que a temperatura do gás é uma medida da energia cinética (média) de translacção das moléculas.
Para que no choque entre duas (ou mais) moléculas tenha origem uma reacção química é necessário, entre outros factores, que a energia cinética das moléculas reagentes esteja acima de um certo limiar.
A energia de activação é a energia que se fornece a um conjunto inicial de moléculas, suficiente para iniciar uma reacção em cadeia, na qual as moléculas dos produtos da primeira geração são suficientemente energéticas para provocar a reacção de uma segunda geração e assim sucessivamente. Esta energia de activação é em geral concretizada através de um aumento localizado da temperatura (faísca eléctrica, chama piloto, etc.)
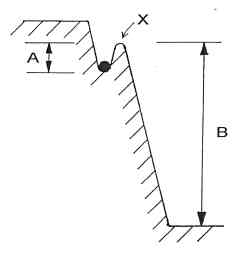
A energia de activação corresponde desta forma a uma espécie de barreira de potencial (A) que os reagentes têm que ultrapassar para atingirem um nivel de energia mais elevado (estado activado X); este estado activado é instável e dá-se a reacção química, com a libertação de energia (B) característica da combustão.
Esta energia de activação é, no inicio, fornecida ao sistema a partir do exterior: o fósforo com que acendemos a lareira, a faísca que fazemos saltar no isqueiro. Quando o material começa a arder é uma parte da energia libertada na combustão que vai servir de energia de activação, para o combustível ainda não queimado. Note-se que o valor da energia de activação (A) é muito menor do que a energia libertada na combustão (B). 
Regressando ao triãngulo do fogo, para que haja combustão é necessária a presença simultânea dos 3 lados do triângulo. A figura ao lado representa essa situação.
Vamos supor que retiramos o lado do combustível. Isto acontece quando rodamos o botão de um fogão a gás que está aceso, cortando o acesso do gás ao queimador, ou se numa fogueira acesa dispersarmos os pedaços de madeira incandescente e em chamas. Retirar o lado “combustível” ao triângulo [1] provoca a extinção do fogo [2].


A terceira hipótese, retirar a energia de activação, verifica-se quando utilizamos a água como agente extintor: a água tem um calor latente de vaporização muito elevado (necessita muita energia para passar de líquido a vapor) e esta energia é “roubada” ao fogo, retirando-lhe assim a energia de activação necessária para dar continuidade à combustão.
O triângulo do fogo é também útil para visualizar as diversas formas de ignição, ou de inicío da combustão.
Consideremos um automóvel no qual o tubo que traz a gasolina do depósito para o motor desenvolve uma fissura, dando origem a um derrame de combustível sobre o motor. Temos 2 lados do triângulo: a energia, materializada no bloco do motor quente, e o ar à volta do motor [1]. Juntamos o terceiro – o combustível – e tem início um incêndio [2].
A forma mais corrente de iniciar a combustão é quando juntamos a energia de activação a dois lados já existentes – combustível e comburente. O fósforo que usamos para acender a lareira, a faísca eléctrica que salta dentro do cilindro do motor e inflama a mistura são exemplos desta forma de ignição.
No contexto de incêndios urbanos, acontece por vezes a acumulação de voláteis combustíveis nas zonas altas do edifício, como sótãos. Temos portanto combustível, e energia de activação, porque esses gases estão a elevada temperatura. A entrada súbita de ar – uma porta que se abre, ou uma janela cujos vidros se partem – provoca o início súbito da combustão, que num espaço confinado assume muitas vezes as características de uma explosão, concretizada no aumento significativo da pressão.
