Alguns vídeos…
Link para alguns vídeos de divulgação científica, feitos no âmbito de um projecto de mestrado em Comunicação de Ciência.
METÁFORAS, ANALOGIAS E MODELOS
Há conceitos científicos que são como cristais, polifacetados. Muito depois de serem apreendidos pela primeira vez, ainda encontramos ângulos de análise que nos surpreendem, permitindo vê-los como uma novidade, sob uma nova luz. Este enriquecimento da compreensão que já tínhamos surge por vezes na forma de uma metáfora.
Embora alguns autores se tenham manifestado contra o uso de analogias e metáforas, de forma mais absoluta ou mais atenuada, é nossa opinião que estas “figuras de estilo” constituem uma ferramenta importante na comunicação de ciência.
Diferenças e semelhanças entre metáforas e analogias
Existem inúmeras definições de metáfora e analogia, consoante os critérios de cada autor que as define.
Metáfora
A palavra metáfora (metapherein), vem do grego e significa “transportar”.
Apresentam-se seguidamente algumas definições de metáfora existentes na literatura, citadas em (Oliveira,1996).
“A metaphor is the transposing of an image or association from one state or arena of meaning to another, highlighting similarities, differences and/or ambiguities” (Duhl, 1983).
“The intentional creation and spontaneous process of metaphoring seem to me to be the key phenomena in the developmental processes of decentralizing” (Piaget, 1978)
“A collection of imagery properties which may be explored for establishing certain theories in pure mathematics in a way more intelligible to many minds and more applicable to physical problems than that in which algebraic symbols alone are used” (James Clerk Maxwell, 1890)
“A metáfora é o resultado da tensão entre dois termos numa enunciação metafórica” (Ricoeur, 1976). Esta definição está aqui colocada apenas como exemplo de definição circular. Mesmo os melhores filósofos podem escrever frases destas!
“Processo interactivo baseado num processo de mapeamento entre o alvo e a fonte” (Gentner e Toupin, 1986).
Esta introdução do processo de mapeamento na definição é quanto a nós essencial e a sua discussão será retomada mais adiante.
Analogia
Etimologicamente significa “de acordo com a razão ” (do Grego: ana “de acordo com” e logos, “razão”). Originariamente era um conceito matemático significando “proporção” (Haaparanta, 1992).
Após a leitura das definições de metáfora, as definições de analogia deixam uma impressão de déjà vu. Seguem-se duas dessas definições.
“Analogia é um processo pelo qual se podem identificar semelhanças entre conceitos diferentes” (Glynn, 1991).
“An analogy is a correspondence in some respects between concepts, principles, or formulas otherwise dissimilar. More precisely, it is a mapping between similar features of those concepts, principles, and formulas” (Glynn et al.,1989)
Diferenças entre os conceitos
Para alguns autores, analogia e metáfora são termos que podem ser utilizados indistintamente. É esta a abordagem que utilizamos no nosso trabalho. Ficam, no entanto, aqui algumas referências de autores que estabelecem a diferença, coligidas em Oliveira (1996).
Duit (1991) distingue analogia de metáfora. Ambas são comparações sendo a analogia uma comparação explícita e a metáfora não. No entanto, sugere que podem ser transformadas uma na outra, pois que a diferença constitui só um pequeno degrau.
Segundo Howard (1989), a metáfora e a analogia estão relacionadas. Uma analogia faz uma comparação explícita ligada por palavras “como” e “semelhante a” ou começando a frase por expressões do tipo: “suponha que” ou ” imagine que”.
Davidson (1979) sintetiza as posições mais comuns sobre a relação entre metáfora e analogia:
“Both analogies and metaphors express comparisons and highlight similarities, but they do this in different ways. An analogy explicitly compares the structures of two domains; it indicates identity of parts of structures. Analogies and metaphors may therefore be viewed as polarities, with in principle may be transformed into one another; that is, analogies may be seen as metaphors, metaphors as analogies”.
Recorrendo novamente a Oliveira (1996), transcrevemos um curto léxico sobre a problemática que temos vindo a discutir:
Alvo (”target”) – objecto desconhecido, total ou parcialmente que vai ser compreendido, descrito, ilustrado, explicado ou previsto através da utilização da metáfora ou analogia.
Fonte (”source”) – objecto conhecido que vai ser usado para compreender, descrever, ilustrar, explicar ou prever o alvo.
Mapear (“mapping”) – processo cognitivo de fazer corresponder os atributos ou as relações entre a fonte e o alvo. Este mapear pode ser interpretado somente como uma correspondência entre os conceitos ou uma correspondência entre domínios conceptuais.
Transferência analógica (“transfer”) – processo cognitivo de transferir os atributos ou as relações da fonte para o alvo resultantes dos processos de mapear e de seleccionar.
Metaforizar – processo cognitivo de compreender, utilizar ou produzir metáforas e/ou analogias.
Linguagem Metafórica – quando se está a referir conjuntamente ou indiscriminadamente a metáfora ou a analogia.
Metáforas e Modelos
A percepção da realidade física não é imediata, pelo que a ciência evolui através da construção de modelos. Os modelos não são em geral metafóricos, embora alguns o possam ser. Mas têm algo em comum com as metáforas e analogias: sendo os modelos assumidamente uma representação simplificada da realidade física, há um mapeamento entre elementos do modelo e certos atributos da realidade, de forma que através do comportamento desses elementos no modelo conseguimos fazer previsões sobre o mundo real.
Como se trata de uma representação simplificada, nem todos os atributos do real são mapeados no modelo. Daí que as previsões do modelo só possam ser feitas no âmbito dentro do qual o modelo foi construído, e que tentativas para extrapolar para fora desse âmbito conduzam em geral ao insucesso. Isto é válido tanto para modelos físicos – onde o desempenho de uma peça de equipamento em escala reduzida nos permite inferir como se vai comportar o equipamento à escala real – como para modelos matemáticos, onde o comportamento do mundo real é simulado por equações que resolvidas analiticamente ou por meios computacionais, permitem que o nosso conhecimento avance.
Esta “não identidade” entre modelo e realidade foi expressa de forma extremamente concisa por Alfred Korzybski: “O mapa não é o território”. Esta expressão aparece pela primeira vez impressa numa sua apresentação a um meeting da AAAS – American Association for the Advancement of Science – em New Orleans, Louisiana, em 1931.
Na sua concisão, a expressão constitui uma metáfora do papel dos modelos em ciência: não são a realidade, mas representam-na de forma adequada no âmbito dentro do qual foram criados.
Anos mais tarde, Jorge Luís Borges, que com frequência utilizava citações inventadas, leva a expressão de Korzybski ao limite da ironia ao publicar o seguinte texto, que atribui a Suaréz Miranda, Viajes de varones prudentes, IV, cap. 45, Lérida, 1658, intitulado:
Do rigor em ciência
… Naquele Império, a Arte da Cartografia conseguiu tal perfeição que o mapa de uma só Província ocupava toda uma Cidade e o mapa do Império toda uma Província. Com o tempo, esses Mapas Desmesurados não satisfizeram e os Colégios de Cartógrafos levantaram um Mapa do Império que tinha o tamanho do Império e coincidia pontualmente com ele. Menos Dadas ao Estudo da Cartografia, as Gerações Seguintes consideraram que esse dilatado Mapa era Inútil e não sem Impiedade o entregaram às Inclemências do Sol e dos Invernos. Nos desertos do Oeste perduram despedaçadas Ruínas do Mapa, habitadas por Animais e por Mendigos; não há em todo o País outra relíquia das Disciplinas Geográficas.
Metáforas na construção da ciência
A história da ciência apresenta vários exemplos famosos do uso de metáforas.
É conhecida a forma como o químico August Kekulé, que formulou a estrutura do anel benzénico, atribui essa ideia a um sonho que teve em que uma serpente mordia a própria cauda.
A “árvore da vida” proposta por Charles Darwin para representar a evolução das espécies é novamente uma metáfora.
Sadi Carnot (1824), no seu Réflexions sur la Puissance Motrice du Feu et sur les Machines Propres à Développer Cette Puissance, publicado em 1824, desenvolve a teoria subjacente à máquina a vapor e à forma como ela produz trabalho por analogia com uma queda de água e o trabalho útil que é possível extrair desta.
Robert Hooke chamou cell à célula, porque ao examinar ao microscópio um pedaço de cortiça, aquilo que viu lembrou-lhe as pequenas celas dos monges nos mosteiros.
Kepler desenvolveu o conceito de movimento dos planetas por comparação com um relógio.
Huygens usou as ondas na superfície da água para teorizar o carácter ondulatório da luz.
Vários exemplos existem de metáforas que por serem tão utilizadas, foram interiorizadas até perderem o seu carácter metafórico. É o que se passa com a corrente eléctrica (sugerida pelo escoamento de um fluido numa conduta), o campo magnético (originado pela ideia de uma extensão de terreno), a informação armazenada na nuvem (quando sabemos que os ficheiros estão em servidores, alojados não sabemos onde, mas certamente num local menos diáfano do que uma nuvem).
A estas metáforas, que na realidade já não o são, chamam os linguistas “metáforas mortas”.
Metáforas na comunicação da ciência
Mencionam-se apenas dois exemplos de grandes comunicadores de ciência.
Richard Feynman, nas suas lendárias “Lectures on Physics” (colocadas online em http://www.feynmanlectures.caltech.edu/), utiliza analogias e metáforas de forma extremamente criativa.
Peter Atkins publicou em 1995 um livro que é todo ele uma metáfora. Nesse livro (Atkins, 1997) a Tabela Periódica é descrita como um território (um reino) com colinas, vales, planícies, lagos onde se situam os diversos elementos químicos.
Advertências contra o uso inadequado de metáforas
Bachelard analisa a linguagem metafórica de um ponto de vista filosófico: “as imagens (…) são, ao mesmo tempo, boas e más, indispensáveis e prejudiciais, é preciso usá-las com medida enquanto são boas e desembaraçar-se imediatamente delas quando se tornam prejudiciais.”
“(…) há que desqualificar o uso figurativo de analogias e metáforas quando pretendem ser imagens-reflexo, mais ou menos exactas, de uma realidade oferecida à investigação, ou seja, quando pretendem passar por cópias fiéis dessa realidade; há que as desqualificar quando se transformam em esquemas gerais que permanecem (obstáculos epistemológicos) em vez de assumirem um papel transitório” ( Bachelard, 1951, citado por Santos, 1991).
Philip Ball (2011) considera que as metáforas influenciam a forma como pensamos. Cita um estudo de Thibodeau e Boroditsky (2011), da Universidade de Stanford que mostra que as pessoas aprovam diferentes respostas em relação ao crime conforme este é apresentado como um “monstro” ou um “vírus” que se espalha na sociedade. No primeiro caso são partidários de leis mais duras, enquanto no segundo advogam soluções como a reabilitação. E manifesta-se contra metáforas do tipo “o gene egoísta”, título do famoso livro de Richard Dawkins, porque a ideia de que os genes são egoístas é totalmente desnecessária para entender como funcionam, e é em muitos aspectos enganadora.
Thomas S. Kuhn (1970) alerta principalmente para o facto de que as metáforas não são imutáveis: “Metaphor plays an essential role in establishing a link between scientific language and the world. Those links are not, however, given once and for all. Theory change, in particular, is accompanied by a change in some of the relevant metaphors and in the corresponding parts of the network of similarities through which terms attach to nature.”
Um exemplo é o modelo do átomo de Bohr, que usa a analogia de um sistema solar em miniatura, com o núcleo no centro (o “sol”) e os electrões orbitando em volta dele (os “planetas”). Esta analogia é hoje apenas utilizada em abordagens muito elementares da física, tendo sido ultrapassada por conceitos mais complexos (a nuvem electrónica, os orbitais).
Boyd (1979), examinando as possíveis desvantagens de usar metáforas na ciência, conclui que “metaphors are appropriate as constituents of scientific theories, so long as their use is governed by realistic standards of precision.” Observa que “Metaphors should be employed only when there is good evidence that an important similarity or analogy exists between the two elements being compared.”
Uma advertência frequente em relação ao uso de metáforas é também comum no que se refere aos modelos: devem ser usados, umas e outros, sempre dentro do seu campo de aplicação.
A metáfora na linguagem quotidiana
Lakoff e Johnson (1980) defendem que, muito para além do uso de metáforas em situações particulares, toda a linguagem quotidiana está alicerçada em metáforas, ou seja, a linguagem de todos os dias é metafórica, mas essa situação está tão interiorizada que não nos apercebemos. Assim, consideram
- Metáforas estruturais (por exemplo, “Time is money”), e mostram que o vocabulário que usamos em relação ao tempo reflecte essa metáfora: poupar e gastar tempo, investir tempo numa dada actividade, etc.
- Metáforas orientacionais (”Happy is up”, “negative mood is down”), ancoradas na experiência física e cultural.
- Metáforas ontológicas, quando personificamos conceitos que o não são, como “a inflação come as poupanças” ou “os mercados ficam nervosos”.
Alguns exemplos de metáforas que usamos com frequência na linguagem corrente: “lavrar a acta da reunião”, “o lobo na pele do cordeiro”, “a ovelha negra da família”, “ataque cirúrgico”, “limpeza étnica”…
Quase poderíamos dizer que vivemos num mundo metafórico.
Referências
Atkins, P. (1997), The Periodic Kingdom: A Journey into the Land of the Chemical Elements (Science Masters Series), Basic Books, UK.
Bachelard, Gaston (1951), L’activité rationaliste de la physique contemporaine, Bibliothèque de philosophie contemporaine, Presses Universitaires de France, 1965, ©1951.
Bachelard, Gaston (1972), Filosofia do Novo Espírito Científico – A filosofia do não, Biblioteca de Ciências Humanas, Editorial Presença.
Ball, Philip (2011), A metaphor too far, Published online 23 February 2011 | Nature | doi:10.1038/news.2011.115
Boyd R. (1979), Metaphor and theory change: what is “metaphor” a metaphor for? (Ortony A. ed.), Metaphor and thought. Cambridge University Press, UK.
Carnot, S. (1824), Réflexions sur la Puissance Motrice du Feu et sur les Machines Propres à Développer Cette Puissance, visto em https://fr.wikisource.org/wiki/R%C3%A9flexions_sur_la_puissance_motrice_du_feu, a 08/06/2018.
Duhl, S. (1983), From the Inside Out and Other Metaphors: Creative and Integrative Approaches to Training in Systems Thinking. New York: BrunnerIMazel.
Duit, R. (1991). On the Role of Analogies and Metaphors in Learning Science. Science Education, 75(6), 649-672.
Gentner, D., Toupin, C. (1986). Systemacity and Surface Similarity in the Development of Analogy. Cognitive Science, 10, 277-300.
Glynn, S. M. (1991). Explaining Science Concepts: a Teaching with Analogies Model. In S.M. Glynn, R.H. Yearny and B.K. Briton (Eds.), The Psychology of Learning Science (pp. 219-240). Hillsdale, New Jersey: Lawrence Erlbaum Associates.
Glynn, S., Sloan, P., Radford, D. (1989). Teaching Science Concepts with Analogies. Unpublished Manuscript, Symposium of University of Georgia. Athens.
Haaparanta, L. (1992). The Analogy Theory of Thinking. Dialectica, 46(2), 169-183.
Howard, R. (1989). Teaching Science with Metaphors. School Science Review, 70 (2), 100-103.
Kuhn, T S. (1970), The structure of scientific revolutions, University of Chicago Press, Chicago.
Lackoff, George and Mark Johnson (2003), Metaphors we live by, University of Chicago Press.
Maxwell, J. C. (1890). The Scientific Papers of J. C. Maxwell, II. Address to the Mathematical and Physical Sections of the British Association. British Association (Report, 1870), 11. Reprinted in W. D. Niven (Ed.), Cambridge: Cambridge University Press.
Oliveira, Maria T. M. (1996), A Metáfora, a analogia e a construção do conhecimento científico no ensino e na aprendizagem. Uma abordagem didáctica., Tese de Doutoramento, Faculdade de Ciências e Tecnologia, Universidade Nova de Lisboa, 1996.
Piaget, J. (1978). A Formação do Símbolo na Criança: Imitação, Jogo e Sonho, Imagem e Representação (3ª ed). Rio de Janeiro: Zahar.
Ricoeur, P. (1976). Teoria da Interpretação. (Traduzido por Artur Morão). Biblioteca de Filosofia Contemporânea. Lisboa: Edições 70.
Santos, Maria E. V. M dos (1991). As concepções alternativas dos alunos à luz da epistemologia bachelardiana. In: Mudança conceitual em sala de aula, um desafio pedagógico. Livros Horizonte, Lisboa, p.128-164.
Sólidos, Líquidos e Gases
No mundo material, as diversas substâncias podem apresentar-se em três estados de agregação que designamos por fases: sólida, líquida e gasosa. Por vezes considera-se um quarto estado da matéria, designado por plasma, que é um gás ionizado, isto é, onde alguns dos átomos perderam electrões e se tornaram assim iões positivos.
Em linguagem simples podemos dizer que um sólido tem forma e volume constante, um líquido tem volume constante, mas a sua forma varia com o recipiente que o contém e um gás não tem forma nem volume constantes, ocupando todo o espaço que lhe for oferecido.
Sendo as substâncias formadas por moléculas, as diversas fases distinguem-se por diferentes graus de coesão entre as moléculas.

Tomemos como exemplo a água. Na fase sólida – gelo – as moléculas ocupam posições relativamente fixas umas em relação às outras. Se fornecermos calor ao gelo, a sua temperatura irá aumentar, o que ao nível microscópico se manifesta por um aumento da vibração das moléculas. Quando se atinge a temperatura de fusão – que no caso da água corresponde a zero graus Celsius – tem início algo diferente: a energia fornecida passa a ser utilizada para desfazer as ligações entre as moléculas. A ligação quase rígida entre as moléculas desaparece com o aparecimento da fase líquida. As moléculas de água estão agora mais livres para se moverem umas em relação às outras.
Note-se que enquanto decorre o processo de fusão, isto é, enquanto temos a coexistência das fases sólida e líquida, a temperatura se mantêm constante; toda a energia fornecida é utilizada para desfazer mais ligações entre as moléculas que constituem a fase sólida.
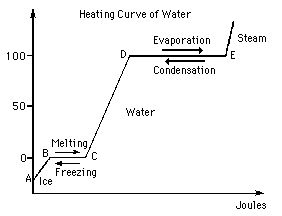
Quando toda a água se encontra líquida, se continuarmos a fornecer calor faremos com que a temperatura da água comece a aumentar. E esta subida de temperatura vai manter-se até o seu valor atingir um novo patamar, 100 ºC – a temperatura de ebulição.
A esta temperatura tem início uma nova mudança de fase: a água líquida começa a passar a vapor. Bolhas de vapor surgem no interior da massa líquida, sobem até à superfície livre do líquido e rebentam, deixando o vapor difundir na atmosfera ambiente.
[É de notar que as primeiras bolhas que se vêm aparecer são de ar que se encontrava dissolvido na água e que se liberta com o aquecimento, porque a solubilidade dos gases nos líquidos em geral diminui com o aumento da temperatura.]
De modo análogo ao que vimos para a fusão, também durante a ebulição a temperatura se manterá constante enquanto houver líquido presente. Todo a energia que fornecemos está a ser utilizada para quebrar as ligações entre as moléculas do líquido, fazendo passar mais moléculas da fase líquida à fase de vapor.
[Note-se que há passagem de moléculas de líquido a vapor a temperaturas inferiores a 100 ºC, mas esta vaporização ocorre apenas na superfície livre do líquido (ao contrário da ebulição que acontece em toda a massa do líquido). Algumas das moléculas da camada superficial conseguem libertar-se da atracção exercida pelas outras moléculas de líquido e afastar-se da superfície, difundindo na atmosfera vizinha. Se não ocorresse esta vaporização, não existiria vapor de água no ar que respiramos.]
As designações gás e vapor merecem uma pequena explicação. Ambas representam o mesmo estado de agregação da matéria. Usamos a palavra gás quando a substância em causa, à pressão atmosférica e a uma temperatura da ordem de 20 ºC existe no estado gasoso. Fala-se de vapor quando nas condições habituais de pressão e temperatura a substância é um líquido (dizemos por exemplo vapor de água ou vapor de gasolina, porque estas substâncias são líquidos nas condições normais de pressão e temperatura, enquanto ao oxigénio ou ao hidrogénio chamamos gás).
Existem também substâncias capazes de passar directamente do estado sólido ao estado gasoso (chama-se a esta mudança de fase sublimação). É costume indicar como exemplos de substâncias que sublimam a cânfora ou a naftalina, mas em rigor a sublimação é um fenómeno mais generalizado. Todas os materiais que têm cheiro é porque sofreram sublimação, porque o nosso sistema de detecção olfactivo – a glândula pituitária – apenas é sensível a moléculas no estado gasoso. À mudança de fase inversa da sublimação chamamos deposição.
Há um aspecto do comportamento da água que importa referir, que é o facto de, ao contrário do que se passa com a quase totalidade dos materiais, o gelo (água sólida) ser menos denso do que a água líquida. Uma consequência positiva é que quando grandes massas de água (rios, lagos, mares) congelam, o gelo mantém-se à superfície, constituindo um isolante que impede a solidificação da fase líquida por baixo da camada sólida, e permitindo que a vida continue na água líquida.
Outra consequência (esta doméstica, e em geral desagradável) é o que acontece a uma garrafa cheia de água deixada por esquecimento no congelador do frigorífico. Aumentando de volume ao congelar, a pressão exercida pelo gelo sobre o vidro da garrafa vai fazê-la rebentar. O desagrado é certamente ainda maior se se tratar de uma garrafa de vinho…
Conhecimento
“A maior parte do que sabemos,
é a menor do que ignoramos”
Padre António Vieira
Os Frutos Dourados do Sol
O livro com o título acima, da autoria de Ray Bradbury, nº 55 da extinta Colecção Argonauta, vem naturalmente à memória no dia de hoje, em que a sonda Parker, enviada pela NASA, saiu da Terra para uma viagem de 7 anos em que tentará descobrir parte do que ainda não sabemos sobre a estrela em torno da qual giramos.
E pensar que o meu nome VIP_Pass vai nessa viagem!
Memórias
Quem trabalhou com este tipo de “objectos” pode deixar um comentário?

E quem não sabe o que é também pode…
O Triângulo do Fogo (2)
Antes de passar aos exemplos de utilização do triângulo do fogo, algumas palavras sobre a energia de activação.
Se apenas houvesse necessidade do combustível e do comburente para se dar a combustão, tudo o que pode arder já teria ardido. Desde as florestas ao recheio das nossas casas, vemos materiais combustíveis rodeados de ar (que contém oxigénio).
Numa perspectiva microscópica, que é o nível onde as coisas acontecem, as reacções químicas ocorrem na sequência de choques entre moléculas. Se tivermos uma mistura de combustível e ar dentro de um reservatório, podemos visualizar as moléculas como partículas em movimento incessante, chocando entre si e com as paredes do reservatório. As moléculas possuem energia sob diversas formas: translacção, rotação, vibração e electrónica. Podemos considerar que a temperatura do gás é uma medida da energia cinética (média) de translacção das moléculas.
Para que no choque entre duas (ou mais) moléculas tenha origem uma reacção química é necessário, entre outros factores, que a energia cinética das moléculas reagentes esteja acima de um certo limiar.
A energia de activação é a energia que se fornece a um conjunto inicial de moléculas, suficiente para iniciar uma reacção em cadeia, na qual as moléculas dos produtos da primeira geração são suficientemente energéticas para provocar a reacção de uma segunda geração e assim sucessivamente. Esta energia de activação é em geral concretizada através de um aumento localizado da temperatura (faísca eléctrica, chama piloto, etc.)

A energia de activação corresponde desta forma a uma espécie de barreira de potencial (A) que os reagentes têm que ultrapassar para atingirem um nivel de energia mais elevado (estado activado X); este estado activado é instável e dá-se a reacção química, com a libertação de energia (B) característica da combustão.
Esta energia de activação é, no inicio, fornecida ao sistema a partir do exterior: o fósforo com que acendemos a lareira, a faísca que fazemos saltar no isqueiro. Quando o material começa a arder é uma parte da energia libertada na combustão que vai servir de energia de activação, para o combustível ainda não queimado. Note-se que o valor da energia de activação (A) é muito menor do que a energia libertada na combustão (B). 
Regressando ao triãngulo do fogo, para que haja combustão é necessária a presença simultânea dos 3 lados do triângulo. A figura ao lado representa essa situação.
Vamos supor que retiramos o lado do combustível. Isto acontece quando rodamos o botão de um fogão a gás que está aceso, cortando o acesso do gás ao queimador, ou se numa fogueira acesa dispersarmos os pedaços de madeira incandescente e em chamas. Retirar o lado “combustível” ao triângulo [1] provoca a extinção do fogo [2].


A terceira hipótese, retirar a energia de activação, verifica-se quando utilizamos a água como agente extintor: a água tem um calor latente de vaporização muito elevado (necessita muita energia para passar de líquido a vapor) e esta energia é “roubada” ao fogo, retirando-lhe assim a energia de activação necessária para dar continuidade à combustão.
O triângulo do fogo é também útil para visualizar as diversas formas de ignição, ou de inicío da combustão.
Consideremos um automóvel no qual o tubo que traz a gasolina do depósito para o motor desenvolve uma fissura, dando origem a um derrame de combustível sobre o motor. Temos 2 lados do triângulo: a energia, materializada no bloco do motor quente, e o ar à volta do motor [1]. Juntamos o terceiro – o combustível – e tem início um incêndio [2].


A forma mais corrente de iniciar a combustão é quando juntamos a energia de activação a dois lados já existentes – combustível e comburente. O fósforo que usamos para acender a lareira, a faísca eléctrica que salta dentro do cilindro do motor e inflama a mistura são exemplos desta forma de ignição.
No contexto de incêndios urbanos, acontece por vezes a acumulação de voláteis combustíveis nas zonas altas do edifício, como sótãos. Temos portanto combustível, e energia de activação, porque esses gases estão a elevada temperatura. A entrada súbita de ar – uma porta que se abre, ou uma janela cujos vidros se partem – provoca o início súbito da combustão, que num espaço confinado assume muitas vezes as características de uma explosão, concretizada no aumento significativo da pressão.
O bosão de Higgs
Numa pausa antes da segunda parte do Triângulo do Fogo, um pequeno conto sobre o bosão de Higgs:
A PARTÍCULA DE DEUS
Meu querido neto
Sabes que nunca apreciei o facto de não teres estudado Direito como o teu avô e o teu pai e teres antes escolhido Física, actividade que sempre vi como um pouco estranha e sem utilidade.
Fiquei contente quando arranjaste esse trabalho no CERN, embora continuasse sem perceber a necessidade de construir máquinas tão caras para partir átomos.
Mas o que hoje li no jornal fez-me reconsiderar a minha atitude. Vem na primeira página, em letras garrafais: “No acelerador gigante, cientistas procuram a partícula de Deus”.
Como São Paulo, subitamente vi a luz!
Junto envio uma caixinha em madeira, com o interior forrado de veludo vermelho. Queria pedir-te para meteres lá dentro uma partícula de Deus e me enviares a caixinha de volta. Quero juntá-la às outras relíquias na capela da casa: o fragmento do Santo Lenho, o pedacinho da tíbia de São Francisco, a madeixa do cabelo de Maria Madalena, e o farrapo do hábito da mártir Santa Úrsula, trazidas pelo teu avô das suas andanças pelo mundo. Embora livre-pensador era um bom homem!
Faz esse favor à tua avó, que nunca se esquece de ti nas suas orações.
Um grande beijo.
O Triângulo do Fogo
O triângulo do fogo indica os três factores que devem estar presentes para que a combustão possa ocorrer. A reacção de combustão é uma reacção química, na qual um tipo particular de substância – a que chamamos combustível – se combina com um oxidante, que na maioria dos casos é o oxigénio do ar, resultando dessa combinação os produtos da combustão. E a principal característica da combustão é ser uma reacção exotérmica, isto é, libertar calor.

Abrir parêntesis:
O que torna os combustíveis substâncias tão especiais? Podemos considerar que as moléculas de combustível contêm energia – denominada energia química – que, em condições apropriadas, é libertada.
E como adquirem as moléculas de combustível essa energia? Podemos exemplificar com o primeiro combustível usado pela humanidade, a madeira.
O principal constituinte da madeira é a celulose, que é um polímero [Polímero: cadeia de moléculas idênticas] formado por moléculas de glucose.
A glucose é produzida na reacção de fotosíntese: a planta absorve CO2 (dióxido de carbono) da atmosfera, água (H2O) do solo, e energia solar; os produtos da reacção são glucose e oxigénio.
6CO2 + 6H2O + Energia → C6H12O6 + 6O2
É desta forma que a planta cresce (aumenta a biomassa) e podemos dizer que a energia solar fica armazenada na biomassa criada.

A combustão é a reacção inversa da fotosíntese.
C6H12O6 + 6O2 → 6CO2 + 6H2O + Energia 
A glucose combina-se com oxigénio e os produtos da combustão são dióxido de carbono e vapor de água. E a reacção liberta energia, como já falámos.
A quantidade de energia absorvida do sol é igual à quantidade de energia libertada na combustão.
A diferença é que a absorção dá-se ao longo de anos enquanto a libertação na combustão ocorre em minutos!
Pensando noutros combustíveis, a formação do carvão (mineral) é o resultado da transformação, ao longo de milhões de anos, de plantas mortas que foram soterradas por camadas sedimentares.
Quanto ao petróleo e gás natural, eles derivam de uma lenta evolução de matéria orgânica que se foi acumulando e sobre a qual sucessivos sedimentos se foram depositando.
Fechar parêntesis
(continua…)
